醫(yī)療器械臨床試驗(yàn)項(xiàng)目結(jié)題指引
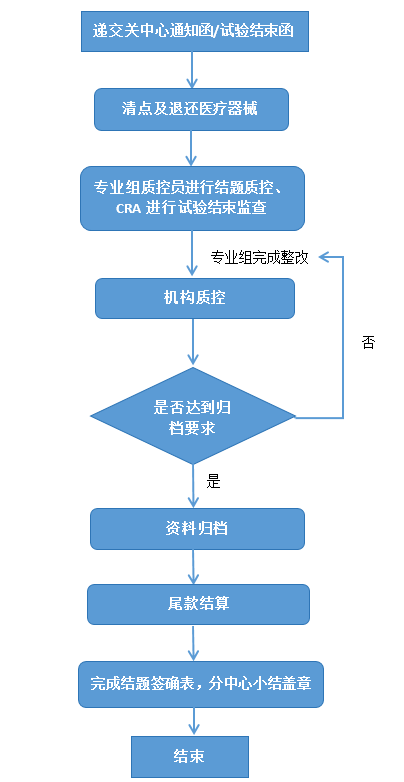
一、申辦者/CRO遞交關(guān)中心函或試驗(yàn)結(jié)束函至PI、機(jī)構(gòu)辦及倫理委員會。
二、完成結(jié)題簽確表。
(一)清點(diǎn)剩余試驗(yàn)醫(yī)療器械及物資,退返剩余醫(yī)療器械申辦者/CRO。
(二)專業(yè)組質(zhì)控員結(jié)題質(zhì)控,CRA完成試驗(yàn)結(jié)束監(jiān)查訪視,所有的問題得到整改后方可進(jìn)行數(shù)據(jù)鎖庫。
(三)按照“醫(yī)療器械臨床試驗(yàn)資料歸檔登記表”的要求整理及裝訂相關(guān)資料,并送往機(jī)構(gòu)辦公室申請結(jié)題質(zhì)控,同時(shí)提交項(xiàng)目總結(jié)報(bào)告及《中山大學(xué)附屬第八醫(yī)院(深圳福田)臨床試驗(yàn)結(jié)題簽認(rèn)表》。
(四)機(jī)構(gòu)質(zhì)控員進(jìn)行結(jié)題質(zhì)控,如發(fā)現(xiàn)問題,填寫質(zhì)控報(bào)告并交予項(xiàng)目負(fù)責(zé)人,要求其對質(zhì)控檢查中發(fā)現(xiàn)的問題進(jìn)行整改及反饋。
(五)確認(rèn)所有問題得到解決后,由機(jī)構(gòu)資料管理員清點(diǎn)所有資料,進(jìn)行歸檔管理。
(六)項(xiàng)目經(jīng)費(fèi):
1. 尾款結(jié)算前應(yīng)完成所有受試者相關(guān)費(fèi)用的報(bào)銷,并與PI確認(rèn)最終的研究者費(fèi)用,與機(jī)構(gòu)辦最后核實(shí)管理費(fèi)等,確定最終尾款。
2. 尾款結(jié)算后方可進(jìn)行結(jié)題確認(rèn)表簽字,并開具發(fā)票。
(七)分中心小結(jié)蓋章:
1. 遞交分中心小結(jié)或總結(jié)報(bào)告給機(jī)構(gòu)辦審核。
2. 完成結(jié)題簽確表后機(jī)構(gòu)辦進(jìn)行蓋章。
?
?
?





